News - Events
Latest news
A selection of recent relevant news
-
Published on
12th iGE3 Annual Meeting
Louis-Jeantet Foundation, Geneva - November 9, 2023 - Registration deadline: October 31, 2023

-
Published on
11th iGE3 PhD Awards - Call for application
For graduate students working in the laboratories of iGE3 members - Registration is closed

-
Published on
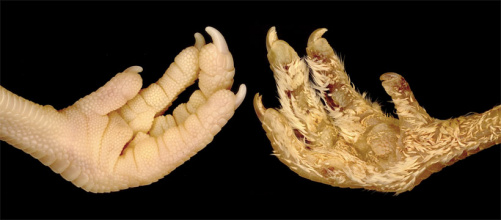
Scales or feathers? It all comes down to a few genes
Publication by Milinkovitch group
-
Published on
Gene responsible for severe facial defects identified
Publication by Antonarakis group
-
Published on
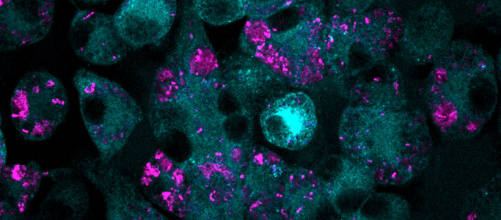
Bypassing antibiotic resistance with a combination of drugs
Publication by Kline group
-
Published on
Prix 3R 2023
Un des Prix 3R 2023 récompense Vladimir Katanaev

-
Published on
Prix Leenaards 2023
Un des trois Prix Leenaards 2023 décerné à Camilla Bellone

-
Published on
iGE3 conference - Silvia Arber
Neuronal circuits for body movements

-
Published on
New iGE3 member - Sophie Martin

-
Published on
New iGE3 member - Christoph Scheiermann

-
Published on
11th iGE3 Annual Meeting
Louis-Jeantet Foundation, Geneva - Hybrid via Zoom

-
Published on
10th iGE3 PhD Awards - Final selection

UNIGE Event Agenda
AtelierSwisscovery : découvrir le nouveau catalogue de la Bibliothèque et le réseau SLSP
More information16.04.2024 10:15 – 11:15 / En ligne, via Zoom
SéminaireWhen TDA meets geometric group theory: A stratification of barcode space using Coxeter complexes (Adélie Garin, EPFL)
More information16.04.2024 10:30 / Conseil Général 7-9 / Room 1-05, Tuesday 16.04.2024, Séminaire "Groupes et géométrie"
SéminaireSeminar from the Department of Cell Physiology and Metabolism PHYM
More information16.04.2024 11:00 – 12:00 / CMU / Auditorium J-L Reverdin
Colloque“Making food systems healthier” ? / «Prévenez-moi ! Une meilleure santé à tout âge » chez Robert Laffont»
More information16.04.2024 11:45 – 13:45 / Campus Biotech / Institut de santé globale Campus Biotech 9, chemin des Mines 1202 Genève Salle de réunion G6-02
SéminaireTalk Giulio Bernardi (CISA lecture)
More information16.04.2024 12:15 – 13:15 / Campus Biotech / H8-01-D
GEDEV SEMINARs - Dr. Bru Tari
More information16.04.2024 12:30 – 13:00 / A. Renold (B01.2426.a)
SéminaireWho Stands on the Shoulders of Chinese (Scientific) Giants? Evidence from Chemistry
More information16.04.2024 12:30 – 13:30 / Uni Mail / Graduate Institute Maison de la Paix, 2 Chemin Eugène-Rigot, Petal 1, Room S5
SéminaireThe geometric properties of exotic aromatic Butcher-series in stochastic backward error analysis (Adrien Laurent, INRIA Rennes)
More information16.04.2024 14:00 – 15:00 / Conseil Général 7-9, Room 1-05, Séminaire d'analyse numérique
Soutenance de thèsePhase Separation of Plus-end Tracking Proteins
More information16.04.2024 14:30 – 16:30 / Ecole de Physique / Salle Stückelberg , Ecole de Physique Quai Ernest-Ansermet 24, 1205 Genève
SéminaireThe Path Integral Perspective of CFT
More information16.04.2024 15:00 – 17:00 / Conseil Général 7-9 / Room 1-07, Séminaire "Groupes de Lie et espaces de modules"
ConférenceConférence publique: Armateur, historien d’art et chocolatier : trois parcours d’amateurs de la porcelaine chinoise au XIXe siècle
More information16.04.2024 18:15 – 19:45 / Uni Mail / M 1160
Projection de filmNaturales Historiae
More information16.04.2024 18:15 – 20:00 / Fonction:Cinéma Rue du Général-Dufour 16 1204 Genève
ConférenceVivre en milieu aride durant le Paléolithique : la Syrie, trait d’union entre l’Europe et l’Afrique
More information16.04.2024 18:30 – 20:00 / Uni Dufour / Salle U259
ExpositionPerspectives – L’univers mathématique de M.C. Escher
More information16.04.2024 07:30 – 19:00 / Bâtiment 66 bd Carl-Vogt / Salle d'exposition de l'UNIGE
AnimationsFestival Histoire et Cité 2024
More information16.04.2024 12:00 – 21:00 / Uni Dufour / divers
ThéâtreThéâtre | Le mal de mère
More information16.04.2024 20:00 – 21:30 / Théâtre de l'Étincelle (Maison de quartier de la Jonction) Av. de Sainte-Clotilde 18bis 1205 Genève
ExpositionÀ travers rues
More information15.04.2024 08:00 – 10.05.2024 17:00 / Uni Dufour, hall Rue du Général-Dufour 24, 1204 Genève
AnimationsHôpital des nounours 2024
More information15.04.2024 – 21.04.2024 / Salle communale du Faubourg, Rue des Terreaux-du-Temple 6, 1201 Genève









