News - Events
Latest news
A selection of recent relevant news
-
Published on
12th iGE3 Annual Meeting
Louis-Jeantet Foundation, Geneva - November 9, 2023 - Registration deadline: October 31, 2023

-
Published on
11th iGE3 PhD Awards - Call for application
For graduate students working in the laboratories of iGE3 members - Registration is closed

-
Published on
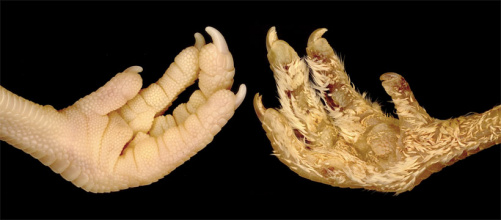
Scales or feathers? It all comes down to a few genes
Publication by Milinkovitch group
-
Published on
Gene responsible for severe facial defects identified
Publication by Antonarakis group
-
Published on
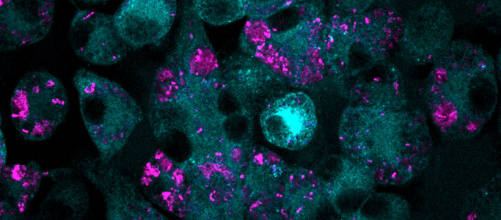
Bypassing antibiotic resistance with a combination of drugs
Publication by Kline group
-
Published on
Prix 3R 2023
Un des Prix 3R 2023 récompense Vladimir Katanaev

-
Published on
Prix Leenaards 2023
Un des trois Prix Leenaards 2023 décerné à Camilla Bellone

-
Published on
iGE3 conference - Silvia Arber
Neuronal circuits for body movements

-
Published on
New iGE3 member - Sophie Martin

-
Published on
New iGE3 member - Christoph Scheiermann

-
Published on
11th iGE3 Annual Meeting
Louis-Jeantet Foundation, Geneva - Hybrid via Zoom

-
Published on
10th iGE3 PhD Awards - Final selection

UNIGE Event Agenda
AnimationsBourse aux vélos
More information18.04.2024 10:00 – 14:00 / Uni Mail / En extérieur, esplanade UNIMAIL côté tram
ConférenceTraditions of ancient ceramics in the Early Medieval and Medieval ceramics of Armenia
More information18.04.2024 10:15 – 11:45 / S.I.P. / Collection des moulages, 10, rue des Vieux-Grenadiers
SéminaireThe Path Integral Perspective of CFT
More information18.04.2024 10:30 – 12:00 / Conseil Général 7-9 / Room 1-15, Séminaire "Groupes de Lie et espaces de modules"
AtelierAtelier de rédaction épicène et inclusive
More information18.04.2024 12:00 – 14:00 / Uni Dufour
SéminaireHOST LIPIDS DEFINE NICHE SPECIFIC COLONISATION OF SALMONELLA
More information18.04.2024 12:15 – 13:15 / CMU / S4/S5
Conférence - débatIn Search of Tunga. Prosperity, Almighty God, and Lives in Motion in a Malian Provincial Town
More information18.04.2024 12:30 – 13:30 / Uni Mail / M4020
Séance d'informationSOS entretien
More information18.04.2024 13:00 – 15:00 / Uni Mail / UniMail M4276 et à distance sur zoom
SéminaireA novel toolkit for computing observables in matter interferometry
More information18.04.2024 13:00 – 14:00 / Ecole de Physique / Room 234
Colloque de printemps : la myopie
More information18.04.2024 13:30 – 17:30 / Marriot Hotel, Chemin du Ruisseau 1, 1217 Genève La salle de colloque se trouve au premier étage.
SéminaireThe monodromy group of a positive braid, and invariant framings.
More information18.04.2024 14:15 – 16:00 / Conseil Général 7-9 / Room 1-15, Séminaire "Topologie et Géométrie"
Séance d'informationOnline Information Session : 4EU+ Visiting Professorships
More information18.04.2024 16:00 – 17:00 / https://4euplus.eu/4EU-415.html?newsID=21651
ConférenceTaming multifaceted Ni catalysts: An academic fascination
More information18.04.2024 16:30 – 18:00 / Sciences II / A-100
ColloqueNeucli Talks : "Update on vestibular, ocular motor and cerebellar disorders“
More information18.04.2024 17:00 – 18:00 / HUG / - En présentiel : HUG, bâtiment Prévost, aile Jura, bureau 7A-2-744/745 (bibliothèque de neurologie) - En visioconférence
ConférenceTheory versus reality: Why do buildings need more thermal energy than designed, and why is it the other way round when it comes to calculating power?
More information18.04.2024 17:15 – 18:45 / Bâtiment 66 bd Carl-Vogt / Salle CV1 (rez-de-chaussée) Retransmission en ligne : voir informations sur notre site www.unige.ch/sysener
Soirée étudianteDatch'Apéro
More information18.04.2024 18:00 – 22:00 / Datcha / Datcha 18 Boulevard d'Yvoy 1205 Genève
Table rondeTABLE RONDE: Censure ou neutralité ? : La guerre entre en Suisse
More information18.04.2024 18:30 – 20:15 / Uni Mail / M2130 INSCRIPTION OBLIGATOIRE, 30 Places uniquement (voir lien ci-dessous)
Projection de filmProjection du film « Frau Mercedes » suivie d'une discussion
More information18.04.2024 20:00 – 22:00 / Cinémas du Grütli, salle Henri Langlois, Rue du Général-Dufour 16, 1204 Genève
ExpositionPerspectives – L’univers mathématique de M.C. Escher
More information18.04.2024 07:30 – 19:00 / Bâtiment 66 bd Carl-Vogt / Salle d'exposition de l'UNIGE
AnimationsFestival Histoire et Cité 2024
More information18.04.2024 12:00 – 21:00 / Uni Dufour / divers
ExpositionÀ travers rues
More information15.04.2024 08:00 – 10.05.2024 17:00 / Uni Dufour, hall Rue du Général-Dufour 24, 1204 Genève
AnimationsHôpital des nounours 2024
More information15.04.2024 – 21.04.2024 / Salle communale du Faubourg, Rue des Terreaux-du-Temple 6, 1201 Genève
ConférenceSéminaire énergie-environnement 2023-2024 / Opportunités et défis pour la transition énergétique
More information28.09.2023 17:15 – 30.05.2024 18:45 / Bâtiment 66 bd Carl-Vogt / Salle CV1 (rez-de-chaussée) Retransmission en ligne : voir informations sur notre site www.unige.ch/sysener


















